نهال گردو ژنویپ چگونه کاشته می شود ؟
نهال گردو ژنویپ چگونه کاشته می شود ؟
عملکرد ، کیفیت آجیل و توانایی انطباق با شرایط خاص آب و هوایی ، همه فاکتورهای مهمی است که باید در توسعه و انتخاب انواع جدید گردوی ایرانی ( Juglans regia L.) مورد توجه قرار گیرد. كنترل ژنتيكي اين صفات هنوز در گردو ناشناخته است و باعث كاهش دقت و سرعت آزاد شدن ارقام جديد براي استفاده تجاري مي شود. ما معماری ژنتیکی پنج صفت برای بازاریابی (به عنوان مثال ، عملکرد ، میوه دهی جانبی و رنگ دانه) یا انتخاب افراد با فنولوژی خاص (به عنوان مثال ، برگ و تاریخ برداشت) بسیار مهم است. با ترکیب بیش از 30 سال داده های فنوتیپی با مشخصات ژنتیکی تولید شده با استفاده از جدیدترین Axiom ™ J. regiaآرایه SNP 700K ، ما قادر به شناسایی و تأیید مکانهای اصلی برای همه این صفات بودیم. به طور خاص ، ما نشان داد که یک منطقه ژنومی در آغاز Chr1 کنترل هر دو برگ و تاریخ برداشت در گردو ، مطابق با ارتباط فنوتیپی قوی مشاهده شده بین این صفات ، و از جمله ژن های نامزد در توسعه گیاه ، تشکیل برگ ، و تقسیم سلول. علاوه بر این ، یک منطقه ژنومی بزرگ در Chr11 که شامل ژن هایی با نقش اصلی در کنترل گل و رشد مریستم ساقه است ، هم میوه و هم عملکرد میوه جانبی آن را تشکیل می دهد. ما یک معماری ژنتیکی پیچیده تر برای رنگ غده مشاهده کردیم ، که به شدت تحت تأثیر محیط قرار دارد ( ساعت 2)= 0.43) ما دو انجمن نشانگر صفت را در Chr6 و 7 برای رنگ غده شناسایی کردیم ، جایی که ژن های رمزگذاری کننده UDP-glycosyltransferase یا درگیر در پاسخ به اکسیداسیون پیدا شدند. در نتیجه ، با ترکیب نقشه های کمی صفات محلی (QTL) نقشه برداری و نقشه برداری ارتباط ژنومی ، برای اولین بار ، مسیرهای مولکولی کنترل فنولوژی گردو ، عملکرد ، میوه دهی جانبی و رنگ دانه را رمزگشایی کردیم. یافته های ما نشان دهنده یک نقطه عطف دیگر در انتقال از پرورش معمول به ژنوم در گردوی ایرانی است.
مقدمه
گردوی ایرانی ( Juglans regia L.) ، بومی کوههای آسیای میانه ، به طور گسترده در مناطق معتدله از قاره آمریکا تا اروپا تا آسیا کشت می شود ( Zeven and Zhukovski، 1975 ). این یک درخت یکپارچه و برگریز است ، با شکوفه های نر و ماده در زمان های جداگانه (هترودیگوگامی). اگرچه خود بارور است ، اما زمان شکوفایی غیر همزمان بین گل آذین های نر و ماده از این گونه گرده افشانی شده توسط باد به شدت برون گذرنده را ترویج می دهد ( ژرمن ، 1997 ). بعضی از درختان گردو فقط از جوانه های انتهایی شاخه ها گل پیستیل تولید می کنند. برخی دیگر قادر به گلدهی در جوانه های جانبی هستند ، صفتی به نام “باروری جوانه های جانبی” که به طور کلی با بازده بالاتر در درختان جوان مرتبط است ( Germain، 1990) میوه گردو از یک هسته ، هسته ، پوسته و پوسته تشکیل شده است. جنین ، که هسته را تشکیل می دهد ، برای اولین بار تقریباً هفت هفته پس از گرده افشانی مشخص می شود و تا اواخر ژوئیه در حفره پوسته اندازه آن افزایش می یابد. در این دوره پوسته تشکیل شده و سفت می شود. پوسته ، پوسته دانه ای که هسته را می پوشاند ، بافتی با منشا مادرانه است و مسئول رنگ ادراک شده هسته است. بین اوت و اکتبر ، پوسته ، بافت گوشتی بیرونی که خود مهره را می پوشاند ، شروع به شکافتن می کند ، این نشان می دهد میوه به بلوغ رسیده و برای برداشت آماده است ( Ramos، 1997 ).
قبل از ظهور اصلاح نباتات ، بهبود ژنتیکی گردو به طور ناخودآگاه از طریق انتخاب و تکثیر بهترین درختان پیش رفت. امروزه این اکتشافات هسته اصلی مجموعه های ژرم پلاسم را تشکیل می دهد که به عنوان پایه و اساس برنامه های تولید مثل در سراسر جهان عمل می کند ( McGranahan and Leslie، 2012 ؛ Pollegioni et al.، 2017 ). یکی از مهمترین برنامه های پرورش گردو ، برنامه بهبود گردو از دانشگاه کالیفرنیا-دیویس (UCD-WIP) است که در اواخر دهه 1940 با هدف توسعه ارقام پیوندی و پایه اصلاح شده برای صنعت گردو کالیفرنیا آغاز شد ( Tulecke و مک گراناهان ، 1994) همانند سایر برنامه های پرورش گردو در سراسر جهان ، هدف UCD-WIP با کاهش نیاز به ورودی (به عنوان مثال ، آب و مواد شیمیایی) و هزینه های تولید ، افزایش عملکرد هسته با کیفیت بصری و طعم مطلوب است ( Leslie and McGranahan، 2014 ). در گردو ، عملکرد به زودرس ، سن درخت ، درصد رشد گل مادگی به آجیل (درصد تنظیم شده) ، اندازه آجیل و به ویژه تعداد گل مادگی تولید شده بستگی دارد ( Solar and Štampar، 2003 ؛ McGranahan and Leslie، 2012 ). در نتیجه ، ترکیب میوه های جانبی ، که معمولاً در درختان گردو از چین غربی و آسیای میانه یافت می شود ، کانون توجه بسیاری از برنامه های پرورش گردو بوده است ( Bernard et al.، 2018a) در کالیفرنیا ، اولین رقم شناخته شده با این ویژگی “Payne” بود که بعداً به عنوان منبع باروری جانبی در UCD-WIP به شدت مورد استفاده قرار گرفت ( Forde، 1975 ).
صفات فنولوژیک ، و چگونگی تناسب آنها با شرایط آب و هوایی محلی ، نیز در انتخاب رقم ، به ویژه در سناریوی فعلی تغییر اقلیم ، یک توجه مهم است. مطالعات اخیر در مورد واکنش های فیزیولوژیکی گردو به گرم شدن کره زمین نشان می دهد که متوسط تاریخ شکستن جوانه ها در برخی مناطق پیشرفت کرده است [به عنوان مثال ، اسلوونی ( Črepinšek و همکاران ، 2009 )] ، اما در برخی دیگر به دلیل عدم سرما در زمستان به تأخیر افتاده است [به عنوان مثال ، کالیفرنیا ( پاپ و دیگران ، 2013 )]. بنابراین ، برخی از مناطق کنونی پرورش گردو می توانند در آینده نزدیک برای کشت گردو نامناسب شوند ، در حالی که مناطقی که در حال حاضر بیش از حد سرد در نظر گرفته شده اند ، می توانند جو مناسبی برای رشد گردو ایجاد کنند ( گاوتیر و جیکوبز ، 2011)) هدف UCD-WIP ، رهاسازی ارقام برگ دیررس است که کمتر در معرض سرماخوردگی اواخر بهار و بیماریهای مربوط به باران قرار دارند ، به ویژه بیماری آفتاب گردو ( Xanthomonas campestris pv. juglandis ). در کالیفرنیا ، اولین رقم کاشته شده گسترده “Payne” است که در اواسط ماه مارس شکسته می شود ، در حالی که آخرین “Franquette” است که در نیمه دوم آوریل منتشر می شود ( Forde، 1975) متأسفانه ، مشخصات دیر برگ نیز به طور معمول با برداشت دیررس مرتبط است. در کالیفرنیا ، برداشت می تواند از اواخر ماه اوت آغاز شود و تا نوامبر ادامه یابد. در سالهای اخیر ، محبوبیت شدید چندلر ، رقم اواخر فصل ، بخش عمده ای از تولید گردو را به قسمت بعدی از فصل برداشت در کالیفرنیا فشرده کرده است ، و در نتیجه استفاده کمتری از تجهیزات و ظرفیت خشک شدن در اوایل پاییز ( لسلی و مک گراناهان ، 2014 ). بعداً برداشت گردو نیز به احتمال زیاد با تاخیر در برداشت و افت کیفیت در اثر باران های پاییزی روبرو می شود ( راموس ، 1997 ). به همین دلایل ، UCD-WIP همچنین قصد دارد ارقام با تاریخ برداشت زودتر از رقم “چندلر” تولید کند.
ویژگی های آجیل در هنگام توسعه و انتخاب انواع جدید به وضوح مهم است. رنگ مغز ، اندازه مهره ، درصد مغز و ضخامت پوسته ، همه معیارهای اساسی برای بازاریابی گردو هستند ( Ramos ، 1997 ). مغز گردو عمدتاً بر اساس رنگ درجه بندی می شود و سبک ترین رنگ با ارزش ترین است. تنوع قابل توجهی در ارقام در توانایی تولید هسته های خارج از نور وجود دارد. معمولاً ، واریته های دیررس احتمالاً به دلیل رسیدن در هوای خنک تر ، هسته های سبک تری تولید می کنند ( Sibbett et al.، 1974) UCD-WIP تلاش قابل توجهی در زمینه تولید ارقام با رنگ هسته با ارزش انجام داده است. از این میان ، “چندلر” و اخیراً “ایوانهو” هر دو برای هسته های مروارید و زرد کم رنگ خود انتخاب شدند و “رابرت لیورمور” ، رقمی که غدد قرمز را به نمایش می گذارد ، در سال 2004 برای بازارهای تخصصی ( مک گراناهان و لزلی ، 2004 ؛ مک گراناهان و لزلی ، 2011 ).
همانطور که سعی در بهبود کارایی آزادسازی ارقام بهبود یافته داریم ، درک کنترل ژنتیکی عملکرد ، فنولوژی و صفات کیفی آجیل برای انتخاب دقیق ژنوتیپ های برتر بر اساس مولکولی بسیار مهم است. در حالی که این صفات به طور گسترده در سایر محصولات مورد مطالعه قرار گرفته است ( Castède et al.، 2015 ؛ Marinoni et al.، 2018 ؛ Larsen et al.، 2019 ) ، تاکنون مطالعات کمی در زمینه برچسب گذاری ژن در گردو منتشر شده است ( برنارد و همکاران ، 2018b ) با استفاده از فرزندان F 2 از چندلر ، دووراک و همکاران. (2016) دو نشانگر همسایه منطقه اصلی ژنومی در گروه پیوند (LG) 11 را شناسایی کرد که میوه داری جانبی را در گردو کنترل می کند. همچنین ، کفایتی و همکاران (2018)یک مکان اصلی صفت کمی (QTL) را برای زمان ورق گذاری شناسایی کرد ، که حسابدارنده 52.0-68.8٪ از واریانس فنوتیپی در یک جمعیت “Chandler” × “Kaplan-86” F 1 است . با این حال ، هر دو این مطالعات تنوع ژنتیکی محدودی را کشف کردند و بنابراین ، فاقد وضوح نقشه برداری بودند. همچنین ، آنها ژنهای کاندیدایی را که اساساً صفات بررسی شده را فراهم نمی کنند. به تازگی ، آرایه جدید Axiom TM J. regia 700K SNP ، که شامل بیش از 600K پلی مورفیسم تک نوکلئوتیدی (SNP) است ، منتشر شد و برای ژنوتیپ مجموعه ای از 1284 مورد جذب گردو از UCD-WIP استفاده شد ( ماررانو و دیگران ، 2018)) در دسترس بودن این صدها هزار پروفایل ژنتیکی امکان بازسازی شجره نامه UCD-WIP و همچنین مطالعات نقشه برداری ارتباطی برای بهره وری استفاده از آب ( Famula و همکاران ، 2019 ) و صفات مربوط به مهره ( عرب و دیگران ، 2019 ) را فراهم کرده است.
در اینجا ، ما استفاده از این منابع ارزشمند ژنومی را برای کالبد شکافی کنترل ژنتیکی پنج صفت مهم در گردو توصیف می کنیم. تاریخ برگ ، تاریخ برداشت ، عملکرد ، میوه دهی جوانه جانبی و رنگ غده. به طور خاص ، ما از نقشه برداری و ارتباط نقشه برداری QTL کلاسیک برای ارتباط داده های ژنوتیپی تولید شده برای 896 درخت گردو با سوابق فنوتیپی جمع آوری شده در UCD-WIP در طول 30 سال استفاده کردیم. با ترکیب دو روش برچسب گذاری ژنی ، مکان های اصلی را برای همه صفات مورد مطالعه شناسایی و تأیید کردیم ، برای اولین بار مسیرهای مولکولی کنترل این فنوتیپ ها را نشان داد و زمینه ای برای تولید ژنومیک به کمک گردو فراهم کرد.
مواد و روش ها
مواد گیاهی و داده های ژنوتیپی
تحقیق حاضر بر روی 896 نفر از افراد مبتلا به UCD-WIP انجام شد ، که شامل چندین رقم شناخته شده گردو (به عنوان مثال ، چندلر ، هوارد ، تولار ، وینا ، Franquette) ، انتخاب پیشرفته و 34 خانواده خواهر و برادر کامل از تلاقی های کنترل شده در سالهای 2004 تا 2010. بزرگترین خانواده “چندلر” x “آیداهو” (CRxID) با 312 نهال بود. خانواده های باقیمانده به طور متوسط 23 نفر بودند ( جدول S1 ). همه افراد با استفاده از آخرین آرایه Axiom TM J. regia 700K SNP همانطور که در ماررانو و دیگران شرح داده شد ، ژنوتیپ شدند . (2018) . برای آزمایش ارتباطات ژنوتیپ-فنوتیپ از SNP های با وضوح بالا (PHR) استفاده شد. کاوشگرهای SNP (71-mer) بر روی ژنوم مرجع گردو سطح جدید کروموزوم (v2.0) نقشه برداری شدند (https://www.hardwoodgenomics.org/Genome-assemble/2539069 ) برای به دست آوردن مکان های کروموزوم آنها. به طور خاص ، موقعیت کروموزومی هنگامی که پروب آن به طور منحصر به فرد بر روی ژنوم با 98٪ هویت و E-value <1e -20 بیش از 95٪ طول آن قرار گیرد ، به یک SNP اختصاص داده شد . سپس مجموعه داده های SNP برای فرکانس جزئی آلل (MAF> 5٪) و میزان گمشده (<20٪) فیلتر شد. مجموعه داده ژنوتیپی این مطالعه را می توان در https://hardwoodgenomics.org/Genome-assemble/2539069 یافت .
تجزیه و تحلیل آماری داده های فنوتیپی
داده های تاریخی فنوتیپ برای تاریخ برگ (LefD) ، تاریخ برداشت (HarD) ، یاطاقان جانبی (LTB) ، عملکرد و رنگ دانه از پایگاه داده UCD-WIP بدست آمد. LefD زمانی است که بیش از 50٪ جوانه های انتهایی شروع به باز شدن می کنند. HarD زمانی است که 95٪ از بدنه از پوسته شل شده است. LefD و HarD هر دو در روزهای جولیان امتیاز گرفتند. LTB به عنوان درصد جوانه های جانبی روی شاخه های کشیده و 1 ساله تعریف می شود. عملکرد براساس ارزیابی بصری با نمره 0 (بدون تولید آجیل) تا 9 (بیشترین عملکرد) است. رنگ Pellicle با استفاده از نمودار رنگی رسمی انجمن خشکبار (DFA) ، که در آن یک نمره نشان دهنده مغز عنبر خارج از نور ، دو – روشن ، سه – کهربا و چهار – کهربای تیره است ، به دست آمد. سپس از نمره DFA میانگین 10 آجیل در هر درخت بعنوان یک رکورد فردی استفاده شد.از ماررانو و همکاران ، 2018 ) برای تخمین ارزش های تولید مثل فردی (EBV) و وراثت در هر صفت استفاده شد. مدل ترکیبی خطی کلی را می توان به صورت نمایش داد
وایکلم= μ +آمن+برمن+سنج+سالک+مسدود کردنمن+هایکلموایکلم=μ+آمن+برمن+سنج+سالک+مسدود کردنمن+هایکلم
جایی که Y ijklm m-th مشاهده ای است که در سال k-th روی درخت i-th از رده سنی j-th گرفته شده و در بلوک L-th واقع شده است. به طور خاص ، a من اثر ژنتیکی افزودنی درخت i-th بر روی صفت است ، pe i سهم محیطی دائمی در فنوتیپ درخت i-th است و e ijklm اصطلاح باقی مانده است. برای محاسبه کوواریانس بین اثرات ژنتیکی افزودنی از ماتریس رابطه عددی استفاده شد. یک اثر محیطی دائمی برای محاسبه کوواریانس بین مشاهدات متعدد از یک درخت در مدل گنجانده شد. هر صفت، مدل های مختلف مناسب بودند، از جمله هر دو من و پلی اتیلنمن ، همیشه به عنوان اثرات تصادفی ، در حالی که سن ، سال و بلوک به صورت تصادفی یا ثابت در انواع ترکیبات است. سپس بهترین مدل براساس معیار اطلاعات بیزی (BIC) انتخاب شد. با توجه به ماهیت طبقه بندی عملکرد ، LTB ، و نمره DFA ، مدل های مخلوط خطی کلی مناسب بودند ، و ارتباط دسته های مرتب مشاهده شده را به تراکم دو جمله ای زیربنایی از طریق عملکرد پیوند probit (عملکرد) یا logit (امتیاز LTB و DFA) نشان می دهند. همه مدل ها با استفاده از روش تخمین REML که در ASReml v4 پیاده سازی شده بود مناسب و حل شدند ( گیلمور و همکاران ، 2009 ). وراثت پذیری باریک ( h 2 ) از هر صفت سپس به عنوان نسبت بین واریانس افزودنی (σ A ) و واریانس فنوتیپی (σ P = σ A) محاسبه شد.+ σ PE + σ e ). پس از آن ، مقدار همبستگی پیرسون (R) بین هر جفت صفت با R / GGally v1.4 ( https://cran.r-project.org/web/packages/GGally/index.html ) بررسی شد. همچنین ، تجزیه و تحلیل مincipلفه های اصلی (PCA) بر اساس مقادیر EBV با استفاده از تابع R داخلی “prcomp” انجام شد.
ساخت پیوند نقشه و تشخیص QTL
استراتژی نقشه برداری شبه testcross برای ساختن نقشه های جداگانه برای هر یک از والدین خانواده F 1 “CRxID” (312 نفر) استفاده شد ( Grattapaglia and Sederoff، 1994 ). نشانگرهایی با نسبت تفکیک تحریف شده ( p-value <0.01) حذف شدند. تجزیه و تحلیل پیوند با استفاده از بسته R / ASMap ( تیلور ، 2015 ) انجام شد ، که با استفاده از الگوریتم MSTmap ( وو و همکاران ، 2008 ) نشانگرها را در گروه های پیوندی قرار می دهد و ترتیب نشانگر بهینه را در هر گروه پیوندی بسیار پیدا می کند. روش کارآمد محاسباتی. نشانگرهایی با مقدار p <1e -12با هم خوشه ای شدند ، و فرکانس های ترکیب مجدد با استفاده از عملکرد نقشه برداری Kosambi به فواصل نقشه ژنتیکی (centimorgans؛ cM) تبدیل شدند (Kosambi ، 1943 ). از نرم افزار MapChart v2.32 ( Voorrips، 2002 ) برای تجسم گرافیکی گروه های پیوند استفاده شد.
از هر دو نقشه والدین برای شناسایی QTL که پنج ویژگی مورد علاقه را کنترل می کند ، استفاده از EBV های منفرد به عنوان ارزش فنوتیپی استفاده شد. تجزیه و تحلیل نقشه برداری QTL در R / QTL v1.44.9 انجام شده است ( برومن و همکاران ، 2003 ). آزمون تک علامت گذاری برای اولین بار انجام شد ، جایی که اثر نشانگر بر روی یک صفت خاص توسط یک رگرسیون خطی ساده بین نشانگر و صفت تخمین زده می شود ( Doerge، 2002 ). سپس ، نقشه برداری از بازه ساده (سیم کارت) استفاده شد. این امتیاز احتمالی QTL قلمداد شده را در فواصل جفتهای مجاور نشانگرهای پیوند خورده تخمین می زند ( Lander and Botstein، 1989 ؛ Haley and Knott، 1992 ). چند نقشه برداری QTL (MQM) نیز انجام شد ، با استفاده از مارکرهای کوفاکتورهایی که با رگرسیون چندگانه و حذف عقب انتخاب شده اند (یانسن ، 1993 ؛ آرندز و دیگران ، 2014 ). آستانه لگاریتم قابل توجه شانس (LOD) ( 05/0 = p-value ) برای هر صفت با آزمون های جایگشت در کل ژنوم تعیین شد (1000 جایگشت ؛ چرچیل و دورج ، 1994 ).
نقشه برداری انجمن ژنوم
از پانصد و هشتاد و چهار فرد ، از جمله همه خانواده های UCD-WIP (به جز “CRxID”) و ارقام ، برای انجام مطالعه ارتباط ژنوم (GWAS) برای پنج صفت مورد مطالعه استفاده شد. GWAS با استفاده از سه مدل مختلف پیاده سازی شده در R / GAPIT v3.0 انجام شد ( تانگ و همکاران ، 2016 ): مدل مخلوط خطی چندگانه (MLMM) ، حل و فصل مدل خطی ترکیبی تحت روابط انحصاری (SUPER) و الگوی ثابت و تصادفی یکپارچه سازی احتمال گردش (FarmCPU). این سه مدل شامل الگوریتم های مختلفی برای افزایش قدرت تشخیص قابل توجه ارتباط نشانگر-صفت در حالی که از مثبت کاذب ناشی از عوامل مخدوش کننده جلوگیری می کند ( Segura et al.، 2013 ؛ Wang et al.، 2014 ؛ Kusmec and Schnable، 2018) هر دو ماتریس خویشاوندی و اجزای اصلی (رایانه های شخصی) برای اصلاح خویشاوندی خانوادگی و ساختار جمعیت گنجانده شدند. به طور خاص ، تعداد رایانه های شخصی با استفاده از عملکرد “model.selection” اجرا شده در GAPIT تعریف شد. برای بررسی اینکه آیا مدل به درستی برای هر دو متغیر مخدوش کننده حساب شده است یا خیر ، از نمودار کمی (quantile-quantile) استفاده شد. تنظیم مقدار P برای آزمایش های متعدد انجام شد ، و Bonferroni مقدار p مهم را اصلاح کرد (= 3.67e -8 ) ، و نرخ کشف دروغین (FDR ≤ 0.05) برای شناسایی ارتباطات شاخص و صفت قابل توجهی استفاده شد.
عدم تعادل پیوند و ژن های کاندیدا
ما از حاشیه نویسی ژن گردوی RefSeq استفاده کردیم ( https://www.ncbi.nlm.nih.gov/genome/annotation_euk/Juglans_regia/100/ ) که روی ژنوم مرجع v2.0 نگاشته شده است تا ژن های کاندیدا را برای فنوتیپ های مورد مطالعه شناسایی کنیم. ما ابتدا چشم انداز LD را در اطراف انجمن های نشانگر-صفت شناسایی شده در همان مناطق ژنومی توسط هر دو نقشه برداری QTL و GWAS بررسی کردیم. با استفاده از روش پیش فرض فواصل اطمینان که در Haploview v4.2 اجرا شده است ( گابریل و همکاران ، 2002 ؛ بارت و همکاران ، 2005) ، ما بلوک های LD را تعریف کردیم. سپس کل منطقه ژنومی واقع در بین SNP های شدید این بلوک های LD بیشتر مورد شناسایی قرار گرفت تا ژن های کاندیدای صفات مورد مطالعه را شناسایی کند. ما همچنین بررسی کردیم که آیا هر یک از SNP ها که در هر یک از آنالیزهای نقشه برداری ژن به طور قابل توجهی مرتبط هستند ، در مناطق ژنی قرار دارند یا خیر.
نتایج
تجزیه و تحلیل آماری داده های فنوتیپی
سوابق فنوتیپی برای همه صفات توسط UCD-WIP از سال 1988 تا 2017 بر روی درختان با سن از یک تا 17 سال جمع آوری شده و در 46 بلوک توزیع شده است. LefD و HarD به طور معمول توزیع شده اند ( شکل S1A ، B ) و کمی زودتر در طول سال های برنامه تولید مثل منتقل شده اند ( شکل S2A ، B ). عملکرد ، نمره DFA و LTB ، برعکس ، صفاتی طبقه بندی شده بودند که دومی شبیه یک توزیع دوجمله ای است ( شکل S1C – E ). عملکرد و LTB از سال 1988 به شدت در UCD-WIP افزایش یافته اند ، در حالی که میانگین نمره DFA تقریباً یک امتیاز کاهش یافته است ( شکل S2C – E) برای محاسبه تأثیر سال ، سن و بلوک بر روی هر صفت ، و برای برآورد م componentلفه ژنتیکی تنوع فنوتیپی ، مدل حیوانی ، که یک مدل مخلوط خطی است که شامل ارزش های تولید مثل فردی به عنوان متغیرهای توضیحی است ( ویلسون و همکاران ، 2010) )، استفاده شد. بر اساس BIC ، بهترین مدل های مخلوط خطی برای LefD و HarD شامل سال ، سن و بلوک به عنوان اثرات ثابت بودند ، در حالی که برای عملکرد و LTB همه متغیرها به عنوان اثرات تصادفی تعریف شدند. برای نمره DFA ، بهترین مدل متناسب شامل سن به عنوان یک متغیر توضیحی نبوده و همه دیگر را به عنوان اثرات تصادفی در نظر گرفت. این نشان می دهد که رنگ غده به طور قابل توجهی تحت تأثیر سن درخت قرار نمی گیرد. h 2 باریک برای همه صفات بالا بود ، به جز میانگین نمره DFA ( ساعت 2)= 0.43) LTB بالاترین ساعت 2 را با 0.98 نشان داد و پس از آن LefD (0.88) ، عملکرد (0.77) و HarD (0.68) قرار گرفت.
بر اساس مقادیر تکثیر نژادی که با توجه به کل مجموعه گردو (896 نفر) تخمین زده شده است ، میانگین HarD 268.4 روز جولیان بود ، با اولین درخت UC-06-005-8 (251 JD) و Scharsch Franquette آخرین (290 JD ؛ جدول 1 ) تاریخ برگ ریزی از 73 روز جولیان (UC-91-031-8) تا 117 (Ronde de Montignac) ، به طور متوسط 89 روز جولیان بود. درصد گلدهی جوانه های جانبی به طور متوسط 73٪ بود که بیش از نیمی از کل مجموعه جانبی بود (30-99٪ گلدهی جوانه جانبی). نمره عملکرد به طور متوسط 5.1 ، با UC-10-025-13 بیشترین بهره وری (نمره 7.8) و نهال UC-06-033-62 کمترین امتیاز عملکرد را نشان می دهد (1.1 ؛ جدول 1) آیداهو دارای بیشترین میانگین نمره DFA برای رنگ غضروف (3.3) ، با بیشتر هسته های عنبر بود ، در حالی که UC-03-001-977 کمترین نمره DFA (1.1) را نشان داد ، که نشان دهنده شایستگی ژنتیکی بزرگ آن در تولید زیاد هسته های خارج از نور است. ( جدول 1 )
میز 1
 جدول 1 آمار خلاصه برای تاریخ برداشت (HarD) ، تاریخ برگ (LefD) ، میوه دادن جانبی (LTB) ، عملکرد و رنگ غده (میانگین DFA) در پانل انجمن و خانواده F1 “Chandler x Idaho” (CRxID).
جدول 1 آمار خلاصه برای تاریخ برداشت (HarD) ، تاریخ برگ (LefD) ، میوه دادن جانبی (LTB) ، عملکرد و رنگ غده (میانگین DFA) در پانل انجمن و خانواده F1 “Chandler x Idaho” (CRxID).
ما ارتباط قوی بین پنج ویژگی اصلی UCD-WIP مشاهده کردیم. به طور خاص ، LefD و HarD همبستگی مثبت داشتند ( R = 0.72 ؛ p-value <0.001) ، که نشان می دهد افراد با برگ زودرس نیز برداشت زودهنگام خواهند داشت ( شکل 1 ) هر دو صفت فنولوژیک همبستگی منفی بالایی را نشان دادند ( R = -0.6 / -0.72 ؛ p-value <0.001) با عملکرد ، نشان می دهد که عملکرد بیشتری در درختان با برگهای اولیه و تاریخ برداشت انتظار می رود. همچنین، تجزیه و تحلیل همبستگی پیرسون نشان داد که افراد با بازدهی بالا به طور کلی جانبی ( R = 0.73؛ مقدار P-value <0.001)، و تولید دانه های اضافی نور بیشتر ( R = -0.65؛مقدار p <0.001؛ شکل 1 )
شکل 1
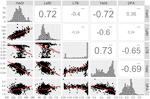 شکل 1 توزیع و همبستگی بین EBV های محاسبه شده برای تاریخ برداشت (HarD) ، تاریخ برگ (LefD) ، یاتاقان جانبی (LTB) ، عملکرد و رنگ غده (DFA). *** p-value <0.001.
شکل 1 توزیع و همبستگی بین EBV های محاسبه شده برای تاریخ برداشت (HarD) ، تاریخ برگ (LefD) ، یاتاقان جانبی (LTB) ، عملکرد و رنگ غده (DFA). *** p-value <0.001.
ساخت پیوند نقشه و تشخیص QTL
با ترکیب استراتژی متقابل شبه آزمون دو و رویکرد نقشه برداری مبتنی بر bin ، دو نقشه پیوند والدین برای بزرگترین خانواده CRxID ساخته شد. نقشه backcross زن (چندلر) در مجموع 1034.37 سانتی متر با 1880 نشانگر تهیه شده در 16 ال جی مربوط به 16 کروموزوم گردو تهیه شده است ( جدول 2 ). کوتاهترین گروه ارتباطی (LG) LG15 با دامنه 40.05 سانتی متر بود که همچنین دارای کمترین تعداد SNP در 21 و بزرگترین منطقه بدون نشانگر نقشه برداری (14.74 سانتی متر) بود. برعکس ، LG8 با 112.58 سانتی متر طولانی ترین LG بود و بیشترین تعداد SNP را داشت که روی یک LG (227 SNP) نقشه برداری شده بود. میانگین چگالی نشانگر در نقشه زن هر SNP5.5 سانتی متر یک SNP بود ، در کل پنج منطقه بیش از 10 سانتی متر بدون هیچ نشانگر مولکولی نقشه برداری شده است ( شکل S3) نقشه مرد (آیداهو) شامل 2،607 SNP توزیع شده در 16 LG با طول کلی 1724،39 سانتی متر بود. طول LG از 66.36 سانتی متر در LG9 تا 148.87 سانتی متر در LG7 ، به طور متوسط طول LG 107.77 سانتی متر بود. کمترین تعداد SNP های تهیه شده در یک LG واحد 101 در LG15 بود ، در حالی که بیشترین 264 مورد در LG9 بود. نقشه نر دارای پنج منطقه بود که هیچ نشانگر مولکولی نقشه برداری نشده و بیش از ده سانتی متر طول داشت. تراکم نشانگر متوسط کمی کمتر از آنچه در نقشه زن مشاهده شد ، با یک SNP در هر 0.66 سانتی متر بود ( شکل S4 ).
جدول 2
 جدول 2 طول و تعداد نشانگرهای مولکولی در هر گروه پیوندی (LG) در نقشه های ژنتیکی چندلر و آیداهو.
جدول 2 طول و تعداد نشانگرهای مولکولی در هر گروه پیوندی (LG) در نقشه های ژنتیکی چندلر و آیداهو.
با تلفیق داده های فنوتیپی و ژنوتیپی از خانواده CRxID ، هفت QTL برای صفات فنولوژیکی شناسایی شد: پنج مورد در چندلر و دو مورد در آیداهو ( جدول 3 ). برای LefD ، یک QTL عمده در LG1 در چندلر ، توضیح دهنده 81.97٪ از کل واریانس فنوتیپی و یک QTL جزئی در LG8 در آیداهو ، که 7.53٪ از تغییرات فنوتیپی را تشکیل می دهد ، مشخص شد ( شکل S5 ). تاریخ برداشت یک معماری ژنتیکی پیچیده تر را به نمایش می گذارد: چهار QTL در چندلر در LG1 ، 5 ، 10 و 12 تشخیص داده شد ، که harD.1 16.78٪ تغییر فنوتیپی را توضیح می دهد ( شکل S6 ). در آیداهو ، QTL اضافی در LG1 برای HarD تشخیص داده شد ، که 7.85٪ از تغییرات صفت را تشکیل می دهد ( شکل S6) برای عملکرد و LTB ، یک QTL عمده در همان منطقه در LG 11 از چندلر شناسایی شد ، که به ترتیب 38.05٪ و 69.67٪ تغییر در میزان تولید آجیل و میوه دهی جانبی را توضیح داد ( شکل S7 ، 8 ). QTL جزئی اضافی برای عملکرد در LG1 در چندلر تنها با تجزیه و تحلیل نقشه برداری چند QTL تشخیص داده شد: این منطقه از 12.43 سانتی متر همچنین شامل harD.1 و lefD.1 ( شکل 2 ؛ شکل S8 ) ، پشتیبانی از ارتباط قوی بین این سه صفات همچنین ، یک QTL جزئی برای LTB در LG6 آیداهو شناسایی شد ، که با تغییر 7.51٪ به تغییر فنوتیپی کمک می کند ( شکل S8) تجزیه و تحلیل نگاشت QTL برای نمره DFA ، دو QTL را فقط بر روی نقشه زن در LG6 و LG7 مشخص کرد ، که به طور کامل 15.36٪ از تغییر رنگ رنگ غده در خانواده CRxID را توضیح می دهد ( شکل S9 ).
جدول 3
 جدول 3 QTL های مشخص شده در چندلر و آیداهو برای رنگ غده (dfa) ، تاریخ برداشت (harD) ، یاتاقان جانبی (ltb) ، تاریخ برگ (lefD) و عملکرد (yld). CI = فاصله پشتیبانی از یک LOD. SNP های زیرخط دار انجمن های چند صفتی را نشان می دهند.
جدول 3 QTL های مشخص شده در چندلر و آیداهو برای رنگ غده (dfa) ، تاریخ برداشت (harD) ، یاتاقان جانبی (ltb) ، تاریخ برگ (lefD) و عملکرد (yld). CI = فاصله پشتیبانی از یک LOD. SNP های زیرخط دار انجمن های چند صفتی را نشان می دهند.
شکل 2
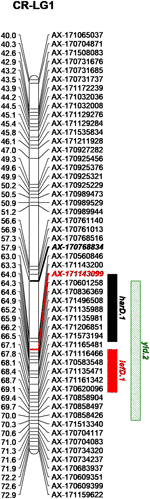 شکل 2 منطقه ژنتیکی در LG1 چندلر شامل QTL های شناسایی شده برای تاریخ برداشت ( harD.1 ) ، تاریخ برگ ( lefD.1 ) و عملکرد ( yld.2 ).
شکل 2 منطقه ژنتیکی در LG1 چندلر شامل QTL های شناسایی شده برای تاریخ برداشت ( harD.1 ) ، تاریخ برگ ( lefD.1 ) و عملکرد ( yld.2 ).
بود
GWAS بر روی 584 نفر از افراد ژنوتیپ باقی مانده ، از جمله ارقام شناخته شده گردو و خانواده های کوچکتر UCD-WIP انجام شد ( جدول S1 ). پانل SNP فیلترشده مورد استفاده برای GWAS شامل 266،224 SNP با موقعیت کروموزومی فیزیکی و 6،436 نوع نقشه برداری روی داربست های بدون لنگر است. برای اهداف عملی ، موقعیت های تصادفی در یک LG17 اضافی به این SNP های بدون لنگر اختصاص داده شد. طبق الگوریتم انتخاب مدل که در GAPIT v3.0 پیاده سازی شده است ، ماتریس خویشاوندی و PC1 برای همه صفات ، به جز LTB و میانگین نمره DFA شامل شدند. تجزیه و تحلیل م componentلفه اصلی نشان داد که محورهای اصلی تغییر درجه ارتباط بین پانل ارتباط را تولید می کنند ( شکل 3 ).
شکل 3
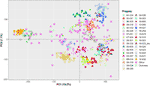 شکل 3 پیش بینی روابط ژنتیکی در میان 586 فرد مورد استفاده برای GWAS بر روی محورهای دو جز components اصلی (رایانه های شخصی).
شکل 3 پیش بینی روابط ژنتیکی در میان 586 فرد مورد استفاده برای GWAS بر روی محورهای دو جز components اصلی (رایانه های شخصی).
تجزیه و تحلیل GWAS 55 انجمن شاخص و شاخص را شناسایی کرد. یاتاقان جانبی بالاترین تعداد SNP های قابل توجه مرتبط را در هر صفت به همراه داشت ، با سه SNP در Chr1 ، چهار SNP در Chr4 ، یک SNP در Chr8 ، یک SNP در Chr9 ، هفت SNP در Chr11 و دو SNP در Chr13 ( جدول S2 ؛ شکل S10 ) . انجمن های نشانگر-صفت در Chr11 منطقه ای 25 مگابایتی را پوشش می دهند که تقریباً 90٪ از واریانس فنوتیپی صفت را شامل می شود (R 2 از 0.01 تا 0.31 متغیر است) ، و همچنین شامل ltb.1 اصلی QTL است که در تجزیه و تحلیل نقشه QTL مشخص شده است. صفت با دومین بالاترین ارتباط معنی دار شناسایی شده LefD بود ، با 14 SNP در Chr1 ، 4 ، 8 ، 10 ، 11 ، 12 ، 13 ، 16 و 17 یافت ( جدول S2 ؛ شکل 4) جالب توجه است ، سه SNP شناسایی شده در Chr1 یک منطقه ژنومی 1.6 مگابایتی را شامل می شوند که شامل نشانگر AX-171143099 در کنار QTL lefD.1 نقشه برداری شده است ( شکل 2 – 4 ). اثر یک جایگزینی آللی بر LefD از 1.09 روز جولیان در مارکر AX-170858858 تا 327.32 در SNP AX-170836301 متغیر بود. تجزیه و تحلیل ارتباط برای LefD همچنین یک SNP را در Chr8 در 1.6 مگابایت از نشانگر AX-170703363 حاشیه QTL جزئی lefD.2 مشخص کرد .
شکل 4
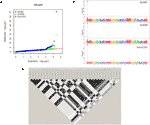 شکل 4 GWAS برای تاریخ برگ گذاری در گردو: (الف) طرح QQ چندگانه و (ب) طرح منهتن برای مدل های MLMM ، SUPER و FarmCPU. (C) بلوک LD در اطراف نشانگر AX-170836301 در Chr1.
شکل 4 GWAS برای تاریخ برگ گذاری در گردو: (الف) طرح QQ چندگانه و (ب) طرح منهتن برای مدل های MLMM ، SUPER و FarmCPU. (C) بلوک LD در اطراف نشانگر AX-170836301 در Chr1.
همانطور که در تجزیه و تحلیل نقشه QTL مشاهده شد ، دو SNP در Chr11 به طور قابل توجهی با عملکرد مرتبط بودند و نقشه برداری نزدیک به مناطق ژنومی مرتبط با LTB داشتند ( جدول S2 ). این دو SNP از فاصله 1 مگابایتی برخوردار بودند و بیش از 20٪ از تنوع عملکرد را در پانل ارتباط توضیح دادند. همچنین ، هشت ارتباط شاخص و شاخص دیگر برای عملکرد در Chr1 ، 2 ، 3 ، 6 ، 7 ، 13 ، 16 و 17 تشخیص داده شد ( جدول S2 ؛ شکل S11 ). تجزیه و تحلیل GWAS برای HarD منجر به بیش از 9 SNP از آستانه مقدار p Bonferroni شد : یکی در Chr1 ، دیگری در Chr3 ، دیگری در Chr10 ، دیگری در Chr11 ، سه در Chr13 و دیگری در Chr16 ( شکل S12 ). نشانگر AX-170770379 در Chr1 1.2 مگابایت به غیر از QTL بود. 1، نقش اصلی این منطقه ژنومی را در تعیین فصل برداشت گردو در کالیفرنیا تأیید می کند ( جدول S2 ). همچنین ، برای رنگ غده ، تجزیه و تحلیل GWAS دو SNP را در مجاورت دو QTL dfa.1 و dfa.2 شناسایی کرد . اولی 2.3 مگابایت از مکان AX-170725746 در Chr6 بود ، در حالی که دومی 6.8 مگابایت از مهمترین ارتباط برای نمره DFA در Chr7 بود. دو SNP دیگر در Chr9 و 12 به طور قابل توجهی با نمره DFA ارتباط داشتند ( جدول S2 ؛ شکل S13 ). همه آنها تأثیر کمی بر فنوتیپ داشتند و برجسته معماری پیچیده ژنتیکی رنگ پوسته در گردو بودند.
بلوک های LD و ژن های نامزد
براساس نقشه برداری QTL و نتایج GWAS ، می توان استنباط کرد که QTL های اصلی در Chr1 برای HarD ، در Chr1 و Chr8 برای LefD ، در Chr11 برای LTB و عملکرد و در Chr6 و 7 برای نمره DFA وجود دارد. انتخاب فعال این صفات در طول سالها در UCD-WIP ممکن است LD اطراف مکانهای هدف را گسترش داده باشد. بنابراین ، ما میزان LD را در مورد مهمترین انجمنهای نشانگر-صفت بررسی کردیم و بلوکهای LD را برای جستجوی ژنهای نامزد درگیر در پنج صفت مورد علاقه تعریف کردیم ( جداول S3 ، 4 ).
دو SNP موجود در Chr1 در ارتباط با HarD در LD با یکدیگر نبودند ( r 2 = 0.03) و در دو بلوک LD مختلف قرار گرفتند: نشانگر AX-170770379 یک بلوک LD 5 کیلو باریکی را به همراه دو SNP دیگر تشکیل داد و قوی بود LD با مجاورترین بلوک LD ، شامل 10 نشانگر و دامنه 25 کیلو بایت ( شکل S14 ). در این ناحیه ژنومی (هر دو بلوک 5-25 کیلو بایت) ، یک ژن کاندیدا (LOC108987959 ؛ جدول S4 ) شناسایی شد ، که برای یک پروتئین TPX2 مانند برنامه نویسی می کند و 1 کیلو بایت از SNP AX-170770379 قرار دارد. نشانگر AX-170768834 ، حاشیه QTL harD.1 ، متعلق به یک بلوک LD کوچک بود (<1 کیلو بایت) که در آن هیچ ژنی قابل شناسایی نیست ( جدول S3 ).
ما همچنین چهار بلوک LD را در مورد مهمترین SNP ها در Chr1 مرتبط با LefD تعریف کردیم. اینها LD با یکدیگر نبودند ( r 2 = 0.03-0.35) ، به استثنای SNPs AX-171143099 و AX-170560823 ، که با هم همبستگی متوسط داشتند ( r 2 = 0.53). نشانگر AX-170858858 یک بلوک LD کوچک (<1 کیلو بایت) بدون هیچ ژن کاندیدای مشروح تشکیل داد ( جدول S3 ). SNP AX-170836301 ، كه در پانل انجمن حداكثر 1/0 داشت ، در يك بلوك LD 71 كيلوگرم قرار گرفت ( شكل 4 ) ، در آنجا 11 ژن كانديد شناسايي شد ( جدول S4 ). در این بلوک LD 71 کیلوبایتی مشاهده شد که نشانگر AX-170836301 در LD قوی است ( r 2= 1) با چهار SNP دیگر ، فقط در دو هاپلوتیپ GTCGG (فرکانس 0.9) و TGTAC (فرکانس 0.1) سازماندهی شده است. دو شاخص مهم SNP دیگر AX-171143099 و AX-170560823 به ترتیب در بلوک های 43 و 13 کیلوبایتی سقوط کردند. در بلوک 43 کیلو بایت ، چهار ژن شناسایی شد ( جدول S4 ). نشانگر AX-171143099 در کد منبع یک LOC108984557 برای یک حمل و نقل ABC قرار گرفت. بلوک LD 13 کیلو بایت شامل سه ژن است که همگی یک سیکلاز اکسید آلن مانند کلروپلاست را رمزگذاری می کنند. برای LefD ، QTL در Chr8 نیز با هر دو روش نقشه برداری ژن شناسایی شد. در حالی که تعریف هیچ بلوک LD برای SNP AX-170703363 امکان پذیر نبود ، به دلیل کم بودن MAF (05/0 <) در صفحه ارتباط ، یک بلوک LD 3 کیلو بایت در اطراف نشانگر AX-170702771 مشاهده شد ( شکل S15) در اینجا منبع LOC109001757 پیدا شده است که رمزگذاری احتمالی ایندول-3-پیروات مونوکسیژناز YUCCA4 ( جدول S4 ) است.
تعریف بلوک های LD برای LTB پیچیده تر بود زیرا شش SNP که به طور قابل توجهی مرتبط هستند ، یک منطقه ژنومی بزرگ 12.5 مگابایت را تحت پوشش قرار می دهند. همچنین ، سه SNP (AX-170908273 ، AX-170909006 ، AX-170960527) در عدم تعادل هاردی-وینبرگ بودند ( p-value <0.01). شش بلوک LD با فشارهای 75 ، 464 ، 49 ، 14 ، 300 و 151 کیلوبایت شناسایی شد ( جدول S3 ). در این بلوک ها ، 91 ژن نامزد پیدا شد و SNP های AX-170722086 و AX-171205312 در دو نوع از آنها سقوط کردند ( جدول S4 ). همچنین ، Chr11 برای بلوک های LD در اطراف سه انجمن مهم ترین ویژگی-مارک مشخص شده برای عملکرد جستجو شد. دو بلوک LD به ترتیب 380 و 233 کیلوبایت پیدا شد که شامل 45 ژن نامزد برای عملکرد است ( جداول S3 – 5) ، 35 مورد از آنها نیز برای LTB مشخص شد.
برای نمره DFA ، میزان LD در دو منطقه ژنومی در Chr6 و Chr7 بررسی شد. در Chr6 یک بلوک با 51 کیلو بایت در اطراف SNP AX-171029756 ( شکل S16 ) و یک بلوک دیگر با 3 کیلو بایت در اطراف مارکر AX-170725746 پیدا شد. هر دو SNP در مناطق ژنتیکی سقوط کردند: مورد اول در مکان های LOC108986141 و LOC109019067 قرار داشت ، به ترتیب کد کننده DEAD-box وابسته به ATP RNA هلیکاز 27 و پروتئین REB1 متصل به DNA بود ، در حالی که دومی در ژن LOC108985377 یافت شد ( جدول S4 ) در منطقه ژنومی Chr7 مرتبط با نمره DFA ، یک بلوک LD (17 کیلو بایت) فقط برای SNP AX-170832900 یافت شد که شامل چهار ژن نامزد برای کدگذاری گلیکوزیل ترانسفرازها و پروتئین های شوک حرارتی بود ( جدول S3 – 4 ).
گذشته از جستجوی ژنهای کاندیدا در مناطق ژنومی اطراف انجمنهای نشانگر-صفت شناسایی شده با هر دو روش نقشه برداری ژن ، ما همچنین بررسی کردیم که آیا سایر SNP های مشخص شده در هر دو نقشه برداری QTL یا GWAS در مناطق کدگذاری قرار دارد. مشخص شد که برای HarD ، نشانگر AX-170620990 در Chr5 و SNP AX-171186285 در Chr11 در دو مکان ژنی (به ترتیب LOC109007348 و LOC108992128) قرار دارند. هشت SNP که به طور قابل توجهی با LTB مرتبط هستند در نه ژن قرار گرفتند ، آنزیم ها و ناقل های رمز کننده درگیر در فرایندهای متابولیسم کربوهیدرات ، سیگنالینگ سلولی و هیدرولیز ATP ( جدول S4 ). همچنین ، برای LefD ، شش SNP در شش ژن نامزد قرار گرفتند ، که برای پروتئازها ، اکسیداز و استیل گلوکوزآمینیل ترانسفراز کدگذاری می شود ( جدول S4) علاوه بر این ، پنج مورد از موقعیت های SNP مرتبط با صفات که در هر یک از دو روش برچسب گذاری ژنی شناسایی شده اند ، باعث تعویض غیر مترادف در توالی های رمزگذاری پروتئین می شوند ( جدول S4 ).
بحث
برای اولین بار در گردو ، ما اساس ژنتیکی پنج صفت مهم را برای پردازش و بازاریابی گردو ، مانند عملکرد ، تحمل جانبی و رنگ غلاف ، یا برای انتخاب افرادی با زمان خاص از وقایع فنولوژی (به عنوان مثال ، برگ زایی) جدا کردیم. و تاریخ های برداشت). مطالعه ما نشان دهنده یک موفقیت بیشتر در یک پروژه طولانی مدت از تولید مولکولی در UCD-WIP است ، که با انتشار ژنوم مرجع گردو آغاز شد ( مارتینز-گارسیا و دیگران ، 2016 ) و به تحقیق مجدد کل ژنوم منتقل شد بنیانگذاران UCD-WIP ( استیونس و همکاران ، 2018 ) برای توسعه آرایه Axiom TM J. regia 700K SNP با تراکم بالا ( ماررانو و همکاران ، 2018) در اینجا ما یک نقطه عطف جدید در ژنتیک گردو به عنوان منبع الهام برای معرفی اصلاح نژاد با کمک ژنومیک در محصولات مغز درخت ارائه می دهیم.
وراثت پذیری و همبستگی صفت
ما با استفاده از داده های فنوتیپی تاریخی ثبت شده در UCD-WIP بیش از 30 سال ، اجزای ژنتیکی را برای پنج صفت مورد علاقه برآورد کردیم. بنابراین ، از آنجا که این داده های فنوتیپی در ابتدا برای هر هدف نقشه برداری ژنتیکی جمع آوری نشده بودند ، از نظر سال ، سن و محلات بسیار ناهمگن بودند. با این حال ، داده های فنوتیپی تاریخی با موفقیت برای مطالعات نقشه برداری ژن در سایر گونه های محصولات درختی ، مانند سیب ( Malus domestica ؛ Larsen و همکاران ، 2019 ) و انگور ( Vitis vinifera L .؛ Migicovsky و همکاران ، 2017 ) استفاده شده است. مارتینز-گارسیا و دیگران (2017)برای پیش بینی مقادیر تولید و اجزای ژنتیکی HarD ، عملکرد ، LTB و نسبت مغزهای خارج از نور تولید شده ، براساس مجموعه شجره نامه UCD-WIP ، از مجموعه ای از بیش از 15 هزار مورد استفاده از گردو استفاده شده است. 896 نفر ما زیرمجموعه ای از این مجموعه بزرگ بودند و بخشی از شجره نامه جدید و دقیق تر UCD-WIP بودند که اخیراً با استفاده از نشانگرهای مولکولی با چگالی بالا بازسازی شده اند ( ماررانو و همکاران ، 2018 ). در دسترس بودن یک شجره نامه با روابط تازه کشف شده و پاک شده از هر گونه خطای ضبط می تواند دقت بیشتری را در تخمین اجزای ژنتیکی برای صفات مورد علاقه تضمین کند. این می تواند اختلاف بین باریک احساس ما توضیح ساعت 2 برآورد و مشاهده شده در مارتینز-گارسیا و همکاران (2017). به طور خاص، ما یک مقدار بالاتر از مشاهده ساعت 2 برای LTB و عملکرد، همراه با بخش قابل توجهی از افراد تحمل جانبی (30-100 درصد از جوانه جانبی گلدهی) و نمره متوسط عملکرد بالاتر است. مقدار h 2 برای HarD (0.68) از مقادیر به دست آمده توسط Martínez-García و همکاران کوچکتر بود . (2017) ، اما مشخص شد که الحاق UC-06-005-8 در هر دو مطالعه اولیه است. این ثبات با توجه به شایستگی ژنتیکی UC- 06-005-8 برای سخت باعث می شود این رقم کاندید خوبی برای پیشبرد فصل برداشت در کالیفرنیا تقریبا 1 ماه (8 سپتامبر هفتم ) نسبت به رقم چندلر (اکتبر 6 هفتم) ما همچنین تخمین می زنیم که 88٪ از تنوع LefD در مجموعه ما قابل توارث باشد. هدف UCD-WIP رهاسازی ارقام دیر برگ برای جلوگیری از بیماری سوختگی گردو است ، بنابراین نیاز به اقدامات کنترل را کاهش می دهد ( راموس ، 1997 ). آخرین ژنوتیپ های برگ دار “Ronde de Montignac” همراه با سایر گونه های فرانسوی مانند “Scharsch Franquette” و “Fernor” بود. به طور کلی ، مقادیر بالای h 2 مشاهده شده برای همه صفات حاکی از آن است که می توان بهبود ژنتیکی موثر و دقیق را برای این فنوتیپ ها تحت طرح های انتخاب خاص پیش بینی کرد ( ویلسون و همکاران ، 2010 ). این در مورد رنگ غضروف صدق نمی کند. واریانس فنوتیپی آن فقط برای 43٪ وراثت بود. همین مورد توسط Martínez-García و همکاران مشاهده شد. (2017)برای نسبت هسته های خارج از نور تولید شده ، تایید ساختار پیچیده ژنتیکی این صفت و وابستگی شدید آن به محیط. ساختار باغ ، فیزیولوژی درخت و شرایط محیطی محیطی که در یک تاج درخت اتفاق می افتد ، همه عواملی هستند که احتمالاً در تغییر رنگ پوسته در گردو موثر هستند. لامپینن و همکاران (2007) مشاهده کرد که به دلیل محدودیت های فتوسنتز مربوط به کمبود نور یا از بین رفتن برگ ، در یک سایبان درخت ، هسته های زرد یا سیاه می توانند در سایبان داخلی قرار بگیرند. در تجزیه و تحلیل همبستگی ما ، میانگین رنگ غده با عملکرد و عادت باروری ارتباط منفی داشت ( شکل 1)) این نتیجه برای پرورش دلگرم کننده است زیرا انتخاب ژنوتیپ هایی با میانگین نمره DFA کم (درصد بالای هسته های سبک یا سبک) میوه دهی جانبی را هدف قرار خواهد داد و بنابراین افراد بسیار پرمصرف. انتخاب صفات چندگانه برای HarD و عملکرد نیز امکان پذیر است: افرادی که دارای تاریخ زودرس برداشت هستند نیز می توانند کاندیدای عملکرد بالا باشند. برعکس ، انتخاب برای افراد دیر برگ و برداشت زودرس به دلیل همبستگی مثبت آنها پیچیده تر خواهد بود. نهالهای دیر برگ احتمالاً بعداً تاریخ برداشت را تغییر می دهد ( Forde، 1975 ).
استراتژی های نقشه برداری ژن
با توجه به این الگوی پیچیده روابط بین پنج صفت مورد مطالعه و تأثیر شدید محیط بر برخی از آنها ، رمزگشایی از کنترل ژنتیکی آنها برای کمک به تولیدکنندگان گردو در توسعه سریع و معرفی ارقام اصلاح شده اساسی است. برای این کار ، ما قدرت نقشه برداری QTL را با وضوح بالای GWAS ترکیب کردیم. ما برای اولین بار نقشه برداری QTL کلاسیک را برای “CRxID” ، بزرگترین خانواده پانل ژنوتیپ ، انجام دادیم که از تلاقی دو والدین با مشخصات بسیار متفاوت در بسیاری از صفات ، به ویژه عملکرد و کیفیت آجیل گرفته شده است. چندلر یکی از پرطرفدارترین ارقام گردو در سراسر جهان است زیرا بسیار میوه ای جانبی است ، برگهای نسبتاً دیری دارد و هسته هایی با رنگ زرد کمرنگ بسیار سبک تولید می کند ( Tulecke and McGranahan، 1994) در مقابل ، “آیداهو” فردی زود برگ و دارای ترمینال است ، که با عملکرد کم و آجیل بسیار بزرگ با کیفیت پایین مشخص می شود ، همانطور که توسط نمره DFA آن تأیید می شود ، بالاترین میزان در تجزیه و تحلیل ما ( جدول 1 ). این دو والدین همچنین اختلافاتی را در طول و تراکم نشانگر نقشه های ژنتیکی خود نشان دادند ، با اینکه نقشه پیوند چندلر از مارکرهای مولکولی کوتاه تر و چگالتر از آیداهو است. یک نقشه اتصال کوتاه زن نیز در کارهای قبلی ساخته شده بود ( Luo و همکاران ، 2015 ؛ کفایتی و همکاران ، 2018 ) ، که احتمال وجود نرخ کم ترکیبی در ماده در گردو را نشان می دهد ( Trivers، 1988 ).
حتی اگر انتخاب والدین در انتهای انتهایی یک ویژگی فنوتیپی احتمال تشخیص QTL ها را افزایش می دهد ، نقشه برداری QTL دارای وضوح نقشه برداری محدود و دقت نسبتاً کمی در تخمین اندازه QTL ها است ( Xu ، 2003 ؛ Collard و همکاران ، 2005 ). علاوه بر این ، اثر QTL شناسایی شده می تواند در زمینه های مختلف ژنتیکی به دلیل تعامل با جایگاه های دیگر ، ترکیب مجدد یا اپیستاز تغییر کند ( هلند ، 2001)) به همین دلایل ، ما تصمیم گرفتیم GWAS را در زمینه ژنتیکی گسترده تری انجام دهیم تا QTL های شناسایی شده با تجزیه و تحلیل نقشه کلاسیک QTL را تأیید کنیم. این پنل انجمن شامل 33 خانواده بود که از طریق عبور از 32 والد ، از جمله چندلر ، والدین زن 22 نفر و پدر و مادر مرد از سه نمونه ، حاصل شده بودند. 32 پدر و مادر با روابط درجه اول و درجه دوم با یکدیگر در ارتباط بودند و همچنین ساختار ژنتیکی متناسب با منشأ جغرافیایی خود را نشان دادند ( ماررانو و همکاران ، 2018 ). پانل ارتباطات تنوع فنوتیپی قابل توجهی بیشتری نسبت به نسل “CRxID” برای همه صفات به جز LTB نشان داد. تقریباً همه افراد تحمل جانبی داشتند و این نشان دهنده سود مثبت ژنتیکی این ویژگی در UCD-WIP است.
استفاده از GWAS اجازه می دهد تا تمام QTL های اصلی موجود در نقشه برداری QTL کلاسیک را تأیید کرده و انجمن های مشخصه و نشانگر اضافی را برای هر پنج صفت مشخص کند ، این امر ماهیت پلی ژنیک آنها را برجسته می کند. بیست SNP ها صفت مرتبط واریانس فنوتیپی کم (R اختصاص 2 ~ 0) ( جدول S2 ). این ممکن است مربوط به MAF پایین باشد که برای برخی از آنها مشاهده شده است (MA15 ≤ 015) ، که نشان می دهد اثر آلل های نادر در برنامه تولید مثل به خوبی نمایان نیست ( Ingvarsson and Street، 2011 ). توضیح دیگری را می توان در روابط بین SNP های مرتبط با صفات و عوامل مخدوش کننده (به عنوان مثال ، خویشاوندی خانوادگی و ساختار جمعیت) یافت ، که می تواند ارتباطات واقعی را تضعیف کند ( Liu et al.، 2016) با این حال ، شناسایی حتی مکان های حسابداری برای مقادیر کمی از تغییرات فنوتیپی کل در صفحه ارتباط ما ، از قدرت و قدرت مدل های GWAS اعمال شده پشتیبانی می کند.
یک منطقه ژنومی در آغاز Chr1 فنولوژیک را در گردو کنترل می کند
هر دو استراتژی برچسب گذاری ژنی QTL های اصلی را برای شروع برگ و تاریخ برداشت در ابتدای Chr1 شناسایی کردند ( شکل 2 – 4 ، S12 ) ، که نشان می دهد یک مسیر مشترک ژنتیکی ممکن است این دو ویژگی را کنترل کند که به شدت با یکدیگر ارتباط دارند ( شکل 1 ).
در طول بهار ، یک شبکه سیگنالینگ پیچیده با واسطه هورمون های گیاهی و عوامل رونویسی آزادسازی خواب را فعال می کند ، و با شکستن جوانه در پاسخ به دمای گرم پایان می یابد ( Falavigna و همکاران ، 2019 ). در این مرحله از بیداری گیاه ، عوامل بیماری زای گیاهان نیز فعال می شوند و گیاه را در معرض خطر بیماری های جدی ، مانند سوختگی گردو قرار می دهند. در این راستا ، ما ژن های کاندیدای LefD را با عملکردهای مربوط به دفاع پاتوژن (ژن LYK2 مانند پروتئین ( Gu et al. ، 2017 ) و بیوسنتز هورمون های گیاهی ، به عنوان اسید جاسمونیک (ژن های اکسید آلن سیکلاز) و اکسین () شناسایی کردیم. ژن YUCCA4) ، گزارش شده است که در رشد گیاه ، پاسخ به تنش و تشکیل برگ نقش دارد ( Cheng et al.، 2007 ؛ Stenzel et al.، 2012) سایر ژن های نامزد شده برای LefD در تشکیل کوتیکول برگ (ژن عضو خانواده 11 خانواده ABC Transporter I ( لنگ و همکاران ، 2014 ) و همچنین در تنظیم پیری برگ و پاسخ به گرسنگی فسفات (فاکتور رونویسی WRKY 75) نقش دارند. ژن ( باکشی و اولمولر ، 2014 ).
حدود 1.7 مگابایت پایین دست از مکان های نامزد در Chr1 برای LefD ، ما پروتئین ژن TPX2 مانند را شناسایی کردیم که احتمالاً در HarD در گردو نقش دارد. پروتئین TPX2 برای مونتاژ اسپیندل در طی میتوز مورد نیاز است ( Wadsworth، 2015 ). میوه گردو با یک فرآیند توسعه دو مرحله ای به بلوغ می رسد. در مرحله اول ، تقسیمات سلولی باعث افزایش اندازه و وزن کل میوه می شود ، اما جنین رشد آن را بیشتر در مرحله دوم رشد میوه تسریع می کند ( راموس ، 1997 ). اکسین بسیاری از جنبه های رشد و نمو گیاه ، از جمله جنین زایی را از طریق خانواده ای از فاکتورهای پاسخ اکسین متصل به DNA که از نظر عملکرد متمایز هستند ، تنظیم می کند (ARFs ؛ Li et al.، 2016) ما یک ژن فاکتور پاسخ اکسین 4 مانند Chr11 را به عنوان منبع کاندیدای HarD شناسایی کردیم. این ژن به طور خاص برای ARF4 کدگذاری می کند ، که درگیر شدن آن در رشد میوه در گوجه فرنگی اثبات شده است ( Sagar et al.، 2013 ). بنابراین ، نقش اصلی پروتئین های TPX2 و ARF4 در طول تقسیم سلولی و رشد میوه ، آنها را به عنوان کاندیداهای قدرتمند برای تنظیم HarD در گردو تبدیل می کند.
ژن های کنترل کننده گلدهی و تکثیر مریستم در شاخه های تحمل جانبی و عملکرد در گردو هستند
انتخاب زیادی که به نفع LTB و عملکرد در UCD-WIP طی سالهای متمادی ایجاد شده است ، یک بلوک LD بزرگ در Chr11 ایجاد کرده است ، جایی که عدم ترکیب مجدد انتخاب بهترین ژن کاندیدا برای این دو ویژگی را با دقت دشوار می کند.
در این منطقه بزرگ ژنومی ، ما ژن هایی را شناسایی کردیم که نقشی اساسی در کنترل گل و تکثیر مریستم ساقه دارند ( جدول S4 ؛ Castède و همکاران ، 2015 ). به عنوان مثال ، ما یک ژن ناقل حامل جریان جریان اکسین 5 را شناسایی می کنیم که هموستاز اکسین داخل سلولی و متابولیسم را تنظیم می کند. اکسین علاوه بر کنترل رشد میوه ، تنظیم کننده اساسی گلدهی در گیاهان است. این سایت محل شروع گل را تعیین می کند ، رشد اندام گل و الگوی تشکیل درون اندام گل را کنترل می کند و تکثیر سلول مریستم گل را تنظیم می کند ( لی و همکاران ، 2016 ). ما همچنین سه ژن رمزگذار FLOWER LOCUS T را پیدا کردیم-INTERACTING پروتئین 1 (FTIP1)، یک تنظیم کننده کلیدی حمل و نقل از پروتئین FT از برگ به ساقه مریستم های رأسی (SAM) برای شروع توسعه گل در پاسخ به طول روز و طول ( لیو و همکاران، 2012 ). تنظیم کننده اصلی دیگر ساعت شبانه روزی و زمان گلدهی ، فاکتور رونویسی مشتق از ترانسپوزاز FAR-RED IMPAIRED RESPONSE1 (FAR1 ؛ جدول S4 ) است ، که نشان داده شده است که نقش اصلی نیز در تعیین مریستم ساقه و رشد گل دارد ( Ma و Li ، 2018 ).
تعمیر و نگهداری و اندازه مریستم های شاخساره توسط یک کنترل ژنتیکی دقیق تنظیم می شود که شامل فاکتورهای مختلف رونویسی و گیرنده ها است. پروتئین گیرنده مانند CLAVATA2 بخشی از این حلقه بازخورد است. جهش یافته آن در ذرت با افزایش تکثیر مریستم گل آذین گوش و تغییر متوسط در اندازه مریستم گل و تعداد اندام ، جذابیت و عملکرد بالایی از خود نشان داد ( تاگوچی-شیوبارا و همکاران ، 2001 ). برای LTB و عملکرد ، ما دو ژن رمزگذار پروتئین CLAVATA2 ، همراه با یک منبع ژنتیکی را برای پروتئین FANTASTIC FOUR 4 (FAF4) ، که رشد شاخساره را در A. thaliana تعدیل می کند ، شناسایی کردیم ( Wahl و همکاران ، 2010 ).
استراتژیهای نقشه برداری دقیق آینده برای شناسایی ژنهایی که از بین 91 ژن شناسایی شده در اینجا ژنهای اصلی ایجادکننده LTB و عملکرد در گردو هستند ، اساسی خواهند بود ( Dvorak و همکاران ، 2016 ). همچنین ، همبستگی زیاد بین عملکرد و LTB ممکن است تشخیص QTL های اضافی را برای عملکرد پنهان کند ، از نظر ژنتیکی بیش از 50 varia از تنوع عملکرد در UCD-WIP غیر قابل توضیح باشد. پروتکل های جدید فنوتیپ کمی برای عملکرد و همچنین مطالعات برچسب گذاری ژنی برای صفات اضافی که عملکرد به آنها تکیه می کند (به عنوان مثال ، درصد تنظیم شده ، وزن مغز) ، به تجزیه بیشتر کنترل ژنتیکی عملکرد در گردو کمک می کند.
ژن های نامزد رنگ Pellicle در گردو
ما همچنین اولین مطالعه در مورد معماری ژنتیکی رنگ پوسته در گردو را انجام دادیم. این ویژگی کیفی از اهمیت بازاریابی بالایی برخوردار است ، زیرا هسته های رنگ روشن قیمت بالاتری را در بازار دارند. Colaric و همکاران (2005) ترکیب فنلی میوه های رسیده را در ده رقم گردو بررسی کرد و مشاهده کرد که محتوای اکثر غلافها نسبت به هسته بسیار بیشتر از فنل است. این غنای طبیعی در ترکیبات فنلی پوسته ، که فقط 5٪ از وزن میوه را نشان می دهد ، به این پوشش نازک نقش محافظتی در برابر اکسیداسیون اسیدهای چرب می دهد. بنابراین ، زیربنای اساسی ژنتیکی رنگ غلاف در گردو نه تنها برای اهداف بازاریابی بلکه برای درک مکانیسم های فعالیت آنتی اکسیدانی و ارزش غذایی گردو مهم است.
ما LOC108991777 را پیدا کردیم که یک UDP-glycosyltransferase ( جدول S4 ) را رمزگذاری می کند ، به عنوان یک ژن نامزد درگیر در رنگ غلاف گردو. خانواده فوقانی UDP-glycosyltransferases شامل آنزیمهایی است که افزودن گروههای گلیکوزیل از یک قند UTP به یک مولکول آبگریز کوچک را کاتالیز می کند و در بیوسنتز بسیاری از متابولیت های گیاهی از جمله رنگدانه های آنتوسیانین نقش دارد ( لی و همکاران ، 2001 ). ژنهای UDP-glycosyltransferases نیز درگیر در رنگ پوست گلابی قرمز شناخته شده اند ( کومار و همکاران ، 2019) ما همچنین مشاهده کردیم که مهمترین SNP مرتبط با نمره DFA در Chr6 در LOC108986141 قرار گرفت ، رمزگذاری یک DEAD-box وابسته به ATP RNA هلیکاز 27 مانند. هلیکازهای RNA جعبه DEAD در هر جنبه از متابولیسم RNA شرکت می کنند. در برنج ( Oryza sativa ) ، یک پروتئین اتصال دهنده ATP به هلیکاز DEAD-box (OsABP) در پاسخ به چندین درمان استرس غیرزنده ، از جمله نمایشگاه آبی و نور قرمز ، تنظیم مجدد شد ( Macovei و همکاران ، 2012 ). بنابراین ، ممکن است که هلیکاز RNA وابسته به ATP جعبه DEAD که در تجزیه و تحلیل ما مشخص شده ، در محافظت در برابر اکسیداسیون غلاف گردو نقش داشته باشد.
نتیجه گیری
با ترکیب نقشه برداری QTL کلاسیک و GWAS ، ما قادر به شناسایی و تأیید مناطق اصلی ژنومی برای همه صفات در مطالعه خود بودیم. با استفاده از این دو روش مکمل برچسب گذاری ژنی ، هر کدام با سطوح مختلف تفکیک پذیری و قدرت ، شامل خطای نوع I (مثبت کاذب) مربوط به استفاده از EBV به عنوان فنوتیپ برای نقشه برداری ژنتیکی هستیم ( Ekine و همکاران ، 2014 ). شناسایی همبستگی های ژنوتیپ-فنوتیپ در همان مناطق با هر دو روش بیانگر دخالت واقعی این مناطق ژنومی در فنوتیپ های مورد علاقه است. در همان زمان ، ما با استفاده از مدل های جدید ، کارآمدتر و قدرتمندتر AM ، که به منظور کاهش خطای نوع II (منفی کاذب ؛ مربوط به رابطه خانوادگی و ساختار جمعیت) حساب می کنیم ( Tang و همکاران ، 2016) تجزیه و تحلیل جامع ما ، برای اولین بار ، ژن های کاندیدای برگ و برداشت خرما ، باردهی میوه ، عملکرد و رنگ غده در گردو را فراهم می کند. اعتبار سنجی انجمن های نشانگر صفت ما در مواد تازه موجود در UCD-WIP و همچنین در مجموعه گردوهای خارجی ، به راه اندازی پرورش به کمک مارکر برای این پنج ویژگی مهم در گردوی ایرانی کمک می کند. همچنین ، برای کمی سازی دقیق و عینی تغییرات فنوتیپی در برنامه های تولید مثل ، باید تلاش های جدیدی در جهت بهبود استراتژی های فنوتیپ انجام شود. روش های جدید فنوتیپ اتوماتیک در UCD-WIP مورد بررسی و آغاز قرار گرفته اند ، خصوصاً در مورد رنگ غضروف ( Sideli et al.، 2019) ادغام این استراتژی های جدید فنوتیپ برای گسترش بیشتر دانش ما در زمینه کنترل ژنتیکی فنولوژی ، عملکرد و کیفیت دانه در گردو اساسی خواهد بود.
جهت بررسي توليد کنندگان انواع نهال در سراسر ايران بر روي گزينه نهال فروش کليک کنيد
منبع : www.frontiersin.org
 نهال گردو ژنویپ چگونه کاشته می شود ؟
نهال گردو ژنویپ چگونه کاشته می شود ؟



